药物动态 第6期

新版《药品召回管理办法》发布
为更好地贯彻落实《药品管理法》《疫苗管理法》,国家药监局组织对 2007 年发布实施的《药品召回管理办法》进行了修订,并于近日发布, 自 2022 年 11 月 1 日起施行。
新版《办法》坚持风险管理、全程管控原则,压实药品上市许可持有人责任, 更好地保障公众用药安全。新版《办法》共 5 章 33 条,明确持有人是控制风险 和消除隐患的责任主体,完善持有人对可能存在质量问题或者其他安全隐患药品 的调查评估要求,细化持有人主动召回实施程序,督促和指导持有人对存在质量 问题或者其他安全隐患药品及时主动召回,切实履行药品全生命周期管理义务。
新版《办法》规定,持有人应当依法主动公布药品召回信息。这有利于社会 各界及时、客观、准确了解药品存在的质量问题或者其他安全隐患,协助和监督 持有人依法依规实施召回。
新版《办法》科学完善召回药品处理措施,对召回药品的标识和存放,以及 对需要销毁的,对可通过更换标签等方式消除隐患的,对不符合药品标准但尚不 影响安全性、有效性的中药饮片,且通过返工等能够解决该问题的情况,均作出 明确规定,在坚守安全底线的基础上,合理减轻了企业负担。
同时,新版《办法》还对境外持有人实施召回、境内生产并出口药品的召回作出明确规定。
(编辑:曹雅茹 校对:王智刚)
落实第七批国家组织药品集中采购工作
7 月 13 日,国家组织药品联合采购办公室发布《全国药品集中采购拟中选 结果公示》,标志着第七批国家组织药品集中采购落幕。根据国家医保局的信息, 本次集采有 60 种药品采购成功,拟中选药品平均降价48%,按约定采购量测算, 预计每年可节省费用 185 亿元。
此次集采,涉及 31 个治疗类别,包括高血压、糖尿病、抗感染、消化道疾 病等常见病、慢性病用药,以及肺癌、肝癌、肾癌、肠癌等重大疾病用药。按集 采前价格测算,算上这次,七批集采 294 个药品涉及金额约占公立医疗机构化学 药、生物药年采购额的 35%。这意味着,集中带量采购已成为公立医院药品采购 的重要模式。另此次集采规则升级有五大亮点,包括带量比例更加科学、“一省 双供”保障供应、品间熔断缩小价差、批件管理防范围标、政策协同持续深化等 等。
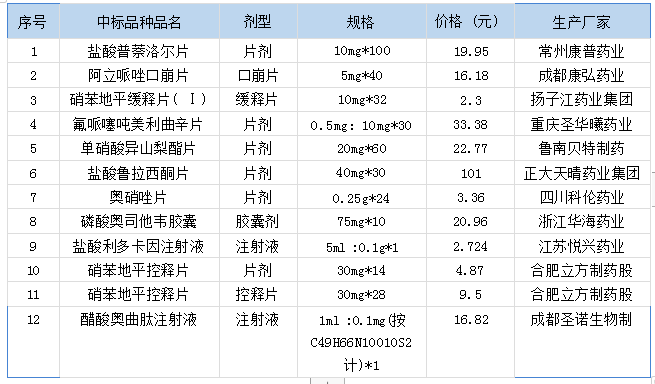
根据皖医保秘〔2022〕96 号文件精神要求,第七批国家集采中选结果自 2022 年 11 月 25 日起开始执行。涉及我院的品种有 12 个,经医院药事管理与药物治疗学委员会会议讨论通过并纳入院目录,具体见下表。
(编辑:朱国萍 校对:王智刚)


甘露特纳胶囊
【规格】150mg*粒 (上海绿谷医药科技有限公司)
【价格】 296.1 元/盒
【适应症】用于轻度至中度阿尔茨海默病,改善患者认知功能。
【用法用量】口服。一次 3 粒 (450mg) ,一 日 2 次。可空腹服用或与食物同服。
【药理作用】动物试验结果显示,甘露特钠对淀粉样蛋白 (Aβ) 、D-半乳糖所 致记忆障碍模型小鼠、东莨菪碱所致记忆障碍模型大鼠的学习记忆有改善作用。 用于阿尔茨海默病的作用机制尚不明确。
【药代动力学】吸收:本品口服生物利用度低,食物对药物吸收无显著影响。分 布:单次口服 450mg、600mg 和 700mg 后,表观分布容积约为 6142.7~9608.7L。 代谢:尚无人体代谢研究数据。清除:排泄途径尚不十分明确,表观清除率约为 117.4~158L/h,蓄积因子约为 2.1~2.6。
【不良反应】常见:心律失常, 口干,血尿,AST、ALT 升高,胆红素升高;偶 见:低血压,腹泻,便秘,食欲下降,头晕头痛,嗜睡,睡眠障碍,尿路感染, 肺部感染,蛋白尿,皮疹,瘙痒,肌无力,癫痫,血糖升高,尿酸升高等。
【相互作用】
目前尚未开展人体药物相互作用研究。体外试验显示:甘露特钠对 CYP450 酶 (CYP1A2、2B6、2C8、2C9、2C19、2D6、3A4) 无抑制作用,对 CYP450 酶 (CYP1A2、 2B6、3A4) 无诱导作用。
【特殊人群】
对于轻度肝功能不全患者,无需根据肝功能调整剂量;对于轻度肾功能不全患者, 无需根据肾功能调整剂量; 尚无中重度肝功能、肾功能不全患者研究数据。
尚无本品用于儿童和青少年的研究资料。目前尚无本品用于妊娠妇女的研究资料。 目前尚无本品用于哺乳期妇女的研究资料,本品能够从哺乳期大鼠的乳汁中泌出, 所以哺乳期妇女应慎用。
【循证依据】
[1] 药品说明书。
[2] 国家药品监督管理局:于 2019 年 11 月 2 日有条件批准了甘露特钠胶囊 (商 品名“九期一”) 上市注册申请,用于轻度至中度阿尔茨海默病,改善患者认知 功能,该药是以海洋褐藻提取物为原料,制备获得的低分子酸性寡糖化合物。 [3] 2020 版阿尔茨海默病的诊疗规范:仅提到国家药监局 2019 年 11 月 2 日有条件批准了甘露特钠胶囊用于轻度至中度阿尔茨海默病,而未做其他推荐。
(编辑:许男奇 校对:左正荣)
盐酸莫西沙星片
【规格】0.4g*6 片 (国为医药)
【价格】 16.24 元/盒
【适应症】莫西沙星在体外显示出对革兰阳性菌、革兰阴性菌、厌氧菌、抗酸菌 和非典型微生物如支原体、衣原体和军团菌具有广谱抗菌活性。
盐酸莫西沙星片用于治疗成人 (≥18 岁) 敏感细菌所引起的下列感染:
①急性细菌性鼻窦炎。为避免发生严重不良反应,且对于一些患者,急性细菌性 鼻窦炎有自限性,应在没有其他药物治疗时方可使用盐酸莫西沙星。
②慢性支气管炎急性发作。为避免发生严重不良反应,慢性支气管炎急性发作有 自限性,应在没有其他药物治疗时方可使用盐酸莫西沙星。
③社区获得性肺炎。
④非复杂性皮肤和皮肤组织感染:由甲氧西林敏感的金黄色葡萄球菌或化脓性链 球菌引起。
⑤复杂性皮肤和皮肤组织感染:由甲氧西林敏感的金黄色葡萄球菌、大肠埃希氏 菌、肺炎克雷伯氏菌或阴沟肠杆菌引起。
⑥复杂性腹腔内感染,包括腹腔脓肿。
⑦鼠疫,包括成人因鼠疫耶尔森氏杆菌(Y.pestis) 引起的肺鼠疫和败血性鼠疫, 也可预防鼠疫。
⑧不伴有输卵管-卵巢或盆腔脓肿的轻至中度盆腔炎性疾病 (即:女性上生殖道 感染,包括输卵管炎和子宫内膜炎) 。由于淋病奈瑟氏菌对莫西沙星的耐药性增 加,不建议本品用于单药治疗轻至中度盆腔炎性疾病,而是应当与另一种合适的 抗菌药物 (例如:头孢菌素) 联合用药,除非能够排除对莫西沙星耐药的淋病奈 瑟氏菌。
【用法用量】成人常用剂量为 0.4g (口服) ,每 24 小时一次。治疗的持续时间 取决于感染的类型:急性细菌性鼻窦炎:10d;慢性支气管炎急性发作:5d;社 区获得性肺炎:7-14d;非杂性皮肤和皮肤组织感染:7d;复杂性皮肤和皮肤组 织感染:7-21d;复杂性腹腔内感染:5-14d;鼠疫:10-14d;轻至中度盆腔炎性 疾病:14d。
【药理作用】莫西沙星是具有广谱活性和杀菌作用的 8-甲氧基氟喹诺酮类抗菌 药。杀菌作用机制:干扰在控制 DNA 拓扑和在 DNA 复制、修复和转录过程中关键 的拓扑异构酶 II 和 IV。莫西沙星表现为浓度依赖性的杀菌活性,最低杀菌浓度 和最低抑菌浓度基本一致。
【药代动力学】吸收:口服后,在胃肠道中吸收良好。莫西沙星的绝对生物利用 度为 90%左右。分布:莫西沙星与血清蛋白的结合率约为 30-50%,与药物浓度不 相关,分布容积在 1.7-2.7L/kg 之间,莫西沙星在体内广泛分布,组织浓度通常 超过血药浓度。代谢:大约 52%的口服给药剂量以葡萄糖苷酸和硫酸盐结合的形 式进行代谢,其中硫酸盐共轭物 (M1) 占莫西沙星给药剂量的 38%,主要通过粪 便排出,另外大约 14%的口服给药剂量被转换成葡萄糖苷酸共轭物 (M2) ,并通 过尿液排出。细胞色素 P450 系统不参与莫西沙星的代谢,并且不受莫西沙星的影响。排泄:大约45%的莫西沙星口服给药剂量以原型药物排出 (尿液中约 20%, 粪便中约 25%) 。共计 96%±4%的口服剂量以原型药物或已知的代谢物形式排出。
【不良反应】
血液和淋巴系统疾病:贫血;胃肠道疾病:腹泻、呕吐、便秘、腹痛、消化不良; 全身性疾病及给药部位:发热;消化系统:丙氨酸转氨酶增加;代谢与营养失调: 低钾血症;神经系统疾病:头痛、头晕;精神疾病:失眠;耳和迷路疾病:听力 损害;肾脏和泌尿系统疾病:肾功能障碍、间质性肾炎。
严重不良反应:肌腱炎和肌腱破裂、周围神经病变、中枢神经系统影响、重症肌 无力的加重、QT 延长。其它严重的、有时甚至是致命的不良反应:过敏反应、 主动脉瘤和夹层的风险、艰难梭菌-相关性腹泻、血糖紊乱、光敏性/光毒性、耐 药细菌形成。
【禁忌】
①对莫西沙星、其他喹诺酮类药物或辅料过敏者禁用。
②有喹诺酮类药物治疗相关肌腱疾病病史的患者禁用。
③基于安全考虑,下列患者禁用:
(1) 先天性或证明有获得性 QT 间期延长患者;
(2) 电解质紊乱,尤其是未纠正的低钾血症患者;
(3) 有临床意义的心动过缓患者;
(4) 有临床意义的心力衰竭并伴有左心室射血分数降低患者;
(5) 既往发生过有症状的心律失常患者。 【特殊人群】
①本品禁用于妊娠期妇女和哺乳期妇女。
②儿童和青少年 (<18 岁) 禁止使用。
③老年患者不必调整用药剂量。老年患者使用会增加肌腱疾病发生的风险,对于 同时使用皮质类固醇的老年患者需谨慎使用,必要时说明潜在的副作用。
④对于肾功能受损的患者,轻中度肝功能不全的患者无需调整剂量。
【循证依据】
[1] 药品说明书。
[2] 2015 年抗菌药物临床应用指导原则:莫西沙星可用于肺炎链球菌和 A 组溶血 性链球菌所致的急性咽炎和扁桃体炎、中耳炎和鼻窦炎等,及肺炎链球菌、支原 体、衣原体等所致社区获得性肺炎,此外亦可用于敏感革兰阴性杆菌所致下呼吸 道感染;莫西沙星可单药治疗轻症复杂性腹腔感染;对于轻症 COPD 或中重度无 铜绿假单胞菌感染危险因素可作为口服替代药。
[3] 2020 中华医学会喹诺酮类抗菌药物急诊临床应用指导意见:对于轻度、中度、 中度或终末期肾病中莫西沙星的药代动力学参数未出现明显变化;推荐莫西沙星 可单用于有误吸风险的 CAP 初始经验治疗;多重耐药感染低风险的非危重 HAP 患者,可选用莫西沙星;慢性支气管炎发作/慢性阻塞性急性加重期 (AECOPD) 初始经验治疗可选用莫西沙星,可延缓 AECOPD 再次发作时间;对于低危腹腔感 染患者可选用莫西沙星单药治疗;莫西沙星可作为耐多药结核病治疗的核心药物, 并作为耐多药结核病短程治疗方案中的基本药物。
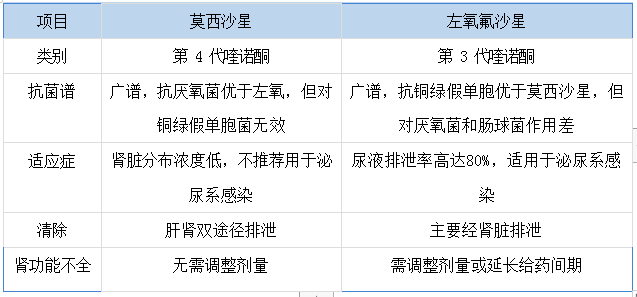
左氧氟沙星与莫西沙星的区别
(编辑:许男奇 校对:左正荣)

超说明书用药,你了解吗?
一、什么叫超说明书用药
医疗机构药品拓展性临床应用,又称“超药品说明书用药 (off-label use of d rugs) ”“药品未注册用法”“药品说明书之外用法”等,本文采用“超药品说 明书用药”这一术语 (下文简称“超说明书用药”) 。“超说明书用药”是指药品使用的适应症、剂量、疗程、途径或人群等未在药品监督管理部门批准的药品说明书记载范围内的用法。
药品说明书更新滞后于医学实践进 步已是全球普遍存在的问题,故超说明 书用药不等同于不合理用药,其体现的 是临床诊疗需求和患者的治疗权益,但 同时,某些超说明书药物的有效性和安 全性尚未得到充分验证,存在未知风险。 因此,无论是为了保障患者最佳治疗权 益、规范临床用药行为,还是为了规避 医疗风险,探索超说明书用药的科学管理方法均具有紧迫性和必要性。
二、医务人员该怎么认识超说明书
2022 年 3 月 1 日起施行的新版《中华人民共和国医师法》首次将诊疗指南和循证医学下的超药品说明书用药写入了法条。既增强了对患者权益的保护,也增加了对医务人员权益的保护。作为医务人员,首先应该熟知什么情况下可以超说明书用药。超说明书用药应该满足的条件是:

(1) 超说明书用药应当限于无合理可替代药品的前提下,如果存在可替代 药品,则不应当超说明书用药。如果医疗机构无该药品,首先应该选择启动临时 采购程序或引进该药品,而不是超说明书用药。
(2) 有循证医学证据支持,主 要包括以下几种情况:相同通用名称药品的国外或国内药品说明书标注的用法; 国内外医学和药学学术机构发布指南认可的超说明书用药;经系统评价或 Meta 分析、多中心大样本随机对照试验证实的超说明书用药;国内外权威医药学专著 已经收载的超说明书用药;单个大样本的随机对照试验证实的超说明书用药。
(3) 需要向医院相关部门提交超说明书用药备案申请,由医院组织相关部门及专家进 行论证,最后经医疗机构药事管理与药物治疗委员会和伦理委员会批准并备案后 方可实施。
(4) 在确定该患者需要超说明书用药后向患者、家属或监护人知情 告知,具体告知用药理由、治疗方案、预期效果及可能出现的风险,最终由患者 自主决定是否进行超说明书用药。
三、精神科药品超说明书用药现状及共识
( 一) 对于精神科医生来说,由于精神科患者常常存在几种精神疾病共病的 情况,超说明书用药在精神科尤其普遍,具体原因有以下几点:
适应证获批的时间滞后、无法涵盖所有的综合征;
有明确适应证的药物数量往往有限,且限于治疗“大病”,如 SCH (精神分 裂症) 、MDD (重性抑郁障碍) 、BPD (边缘性人格障碍) ;
一些少见或罕见病例,超说明书用药可能是唯一的选择;
临床病例不同于临床试验的病例,更复杂,一个病人可能存在多种疾病的共病;有其他适应证的药物因过专利保护期,制药行业不申请新的适应症;
超说明书用药确有其市场,如:促进临床实践的创新、作为常规治疗效果差 的辅助或强化治疗、老药新用等等;
精神药物在我国批准适应证更少;而且治疗剂量范围不同;
不同剂型或来源的同一药物适应证不同;
药物在我国人群中的研究数据有限;如人群多是 18-65 岁间等; 我国地域广阔,环境因素影响,如药物的可获得性等;
鉴于种种客观原因,超说明书用药已经成为临床工作中不可或缺的一部分。 但实际上,将药品用于药品说明书规定范围以外,无论对患者,医生,甚或是医疗机构,都存在巨大的风险。
(二) 2022 年 6 月 28 日,广东省药学会发布《超药品说明书用药目录 (2022 年版) 》,为各级医疗机构临床药物治疗与药事管理提供重要参考依据和技 术支撑。下表为超说明书目录中的精神科药物部分。

备注:
1.《超药品说明书用药目录 (2022 年版) 》完整版请在广东省药学会官网 (http://sinopharmacy.com.cn/) 下载; 2.FDA 说明书可在 FDA 官网上下载:http://www.fda.gov/;
3.本目录仅罗列超说明书用药证据,非推荐目录,供医疗机构参考,超说明书用药应按正规流程规范管理;
4.引用本目录内容时请注明出处。
四、如何合理应对精神科超说明书用药这一挑战?
医疗机构应按照法律规定,建立超说明书用药管理制度,对院内超说明书用 药行为进行监控,保障患者利益,维护医疗安全,在赋予医师诊治特殊疾病、疑 难重症等自主权的情况下,严格规范医师诊疗行为,更好地救助患者。
参考文献:
[1] 中华医学会儿科学分会临床药理学组,《中华儿科杂志》编辑委员会.中国
儿科超说明书用药专家共识[J]. 中华儿科杂志,2016,54:101- 103.
[2] 广东省药学会.超药品说明书用药目录 (2022 年版新增用法) [J].今日药学, 2022,32(6):401-408.
[3] 陈新谦,金有豫,汤光.新编药物学[M].第 17 版.北京:人民卫生出版社,2011. [4] 陆林.沈渔邨精神病学 (第 6 版) [M].人民卫生出版社.2018.
(编辑:朱亚男 校对:左正荣)

警惕超剂量使用注射用阿莫西林钠可能 增加肾损害发生风险
为提醒广大医务人员严格按说明书规定的用法用量合理使用阿莫西林钠,用 药过程应该加强肾功能监测,避免单次剂量过大或长时间使用,以减少严重肾损 害的发生。
阿莫西林为青霉素类抗生素,通过抑制细菌细胞壁合成,使细菌膨胀、裂解 而发挥杀菌作用。对肺炎链球菌、溶血性链球菌等链球菌属、不产青霉素酶葡萄 球菌、粪肠球菌等需氧革兰阳性球菌,大肠埃希菌、奇异变形杆菌等需氧革兰阴 性菌的不产β 内酰胺酶菌株及幽门螺杆菌具有良好的抗菌活性。注射用阿莫西林 钠适用于敏感菌所致各种感染中病情较重需要住院治疗或不能口服的患者。
国家药品不良反应监测中心病例报告数据库收到注射用阿莫西林钠的不良 反应/事件主要表现为:皮肤及附件损害、消化系统损害、全身性损害、呼吸系 统损害、神经系统损害、泌尿系统损害等。
一、注射用阿莫西林钠严重病例的临床表现
注射用阿莫西林钠严重病例不良反应/事件累及系统前三位的分别是:全身 性损害,主要表现为过敏性休克、过敏样反应、高热等;泌尿系统损害,主要表 现为血尿、急性肾衰竭、肾功能异常、间质性肾炎等;呼吸系统损害,主要表现 为呼吸困难、胸闷、憋气、哮喘等。
典型病例:患者,男性,49 岁,因发热、咳嗽就诊。给予注射用阿莫西林 钠 3g 静脉滴注,用药过程中患者出现心悸、胸闷、呼吸困难、 口唇发绀,体温 37.6℃,血压 40/18mmHg,考虑为过敏性休克,立即停药,给予抗休克治疗后, 患者好转。
二、注射用阿莫西林钠肾损害病例情况分析
国家药品不良反应监测中心病例报告数据库中有关注射用阿莫西林钠肾损 害病例,肾损害具体表现为:血尿、急性肾衰竭、肾功能异常、尿频、排尿困难、 蛋白尿、间质性肾炎、尿结晶、少尿、无尿等。
( 一) 典型病例介绍
典型病例 1:患者,男性,28 岁,因急性上呼吸道感染就诊。查体:发热、 咳嗽、咽充血、扁桃体肿大、体温 39℃,给予注射用阿莫西林钠 3g 静脉滴注,1 小时后患者出现尿频、尿痛、肉眼观察有血尿,立即停药。尿常规:鲜红色, 尿蛋白 (+/-) ,红细胞 (++++) ,白细胞 (+) 。未做任何处理, 5小时后患者 症状减轻,嘱多饮水,次日查尿常规正常。
典型病例 2:患者,女性,因上呼吸道感染给予注射用阿莫西林钠 4.5g,加 入 0.9%生理盐水 250ml注射液中静脉滴注,用药后 1 小时患者出现下腹胀痛, 血尿,后出现无尿。B 超提示双肾积水,包膜下积液;肾功能检查:BUN8.37mmol/L、 Scr163umol/L,诊断为急性肾功能衰竭。停药,给予碱化尿液,采用经皮肾盂穿 刺置管引流术,术中见双输尿管阻塞,尿道内有大量结晶。给予相关治疗,患者 情况逐渐好转。
(二) 注射用阿莫西林钠肾损害的特点:
1、多为速发型反应,严重程度具有剂量相关性,剂量越大,严重程度越高, 但经及时停药救治预后较好。
2、以 50 岁以上老人和 10 岁以下儿童多见。
3、在正常剂量和超剂量使用下均有发生肾损害的可能性,超剂量用药引起 的肾损害起病时间短、恢复慢,更为严重。
三、相关建议
建议医务人员严格按照药品说明书规定的用法用量给药,用药过程应该加强 肾功能监测,避免单次剂量过大、浓度过高、滴速过快或长时间使用;对肾功能 障碍患者、老年患者应注意调整用药剂量,对于未成年患者应按体重给药,并应 告知监护人风险,加强随访和监测。
建议药品生产企业应对说明书相关内容进行修订,完善风险提示信息;加大 药品不良反应监测力度,加强临床合理用药的宣传,确保产品的安全性信息及时 传达给患者和医生;制定并实施有效的风险管理计划,保证用药安全。
(信息来自国家药品监督管理局官网)
(编辑:朱亚男 校对:左正荣)
欧盟评估 5-羟色胺受体抑制剂对动物精子质量影响 及与人类的相关性
欧盟人用药物警戒工作组近期对选择性 5-羟色胺再摄取抑制剂 (SSRI) 对 精子质量及男性生育能力的影响进行了评估。欧盟要求更新产品信息,以反映动 物研究结果提示 SSRI 可能会影响精子质量,但并未观察到其在人类中对男性生 育能力有影响。建议患者不应依据这些研究结果停用 SSRI,若有顾虑,应与他 们的医生联系。
在一些研究发表后,人用药物警戒工作组已进行了一个关于帕罗西汀对精子 质量和对男性生育能力影响的评估,评估的数据包括医学文献、临床研究和原研 药上市许可持有者的临床安全性数据库。2010 年对帕罗西汀的产品信息进行了 更新,此更新反映了当时对此药物可获得和信息。但对帕罗西汀的医学文献回顾 不足以得出其他 SSRI 在抑郁症、强迫症和焦虑症的治疗中也具有类效应,这是 由于在期刊上不同 SSRI 的观察结果不同。因此,药物警戒工作组同意对所有与 这个问题相关的数据进行重新审查,以确定这是否是一个类效应。
欧盟要求西酞普兰、艾司西酞普兰、氟西汀、氟伏沙明和舍曲林的原研药上市许可持有者提交所有临床试验、非临床 (动物) 研究、观察性研究和自发报告 的数据,以及对精子质量 (即精子完成受精的能力) 和男性生育能力影响的数据 综述。帕罗西汀的数据先前已被要求提交和评价。所有这些数据显示了除舍曲林 外的其他 SSRI 对动物精子质量的损伤及其对雄性动物生育能力的研究结果,如下所示:
·对于氟伏沙明,当活性物质血浆水平高出人类临床使用中达到水平的三倍 时观察到不良影响,由于个体差异,不能完全排除临床相关性。未提供关于氟伏 沙明对人类生育能力影响的临床数据。
·对于西酞普兰,当活性物质水平超过人类临床使用中达到水平时观察到影 响。临床数据不能确认西酞普兰在人类中的反应,且亦未确认艾司西酞普兰在人 类中的反应。
·对于氟西汀,动物研究显示其可能对精子质量有影响,但仅在其剂量高于 最大耐受剂量时观察到其对雄性生育能力的影响。这些结果并未得到人类临床数 据的证实。
药物警戒工作组认为,虽然动物试验数据间有差异,但总体而言,这些动物 研究显示 SSRI 可能会影响精子质量。在动物模型中,大多数 SSRI 在其血清水平 超过人类临床使用水平时与对雄性生育能力的影响有关。有少数患者病例报告描 述了 SSRI 对精子质量的影响。在这些罕见病例中,该影响是可逆的。未在人类 中专门进行对男性生育能力影响的研究观察,但在现有临床数据中未观察到与 SSRI 相关的人类男性生育能力损伤。
药物警戒工作组总结其评估结果,建议在欧盟批准上市的包含酞普兰、艾司 西酞普兰、氟西汀、氟伏沙明、帕罗西汀或舍曲林的所有药品均应包括上述 SSRI 对精子质量和男性生育能力影响的信息。因此,应对药品特性摘要 (SPC) 的临 床前安全性数据部分和关于生育能力的部分进行更新,更新的内容应分别根据每 种活性物质的已有数据,并声明在人类中观察到的对精子质量影响(若存在的话) 是可逆的,以及至今在人类中未观察到其对男性生育力的损害。
(英国 EMA 网站)
(编辑:朱亚男 校对:左正荣)
